| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 切除不能大腸癌 | 三次治療以降 | 第3相 | 全生存期間 | 中国・韓国・タイ | なし |
試験名 :TERRA
レジメン:トリフルリジン/チピラシル塩酸塩 (FTD/TPI) vs プラセボ
登録期間:2013年10月16日〜2015年6月15日
背景
FTD/TPIは, J003試験及び国際共同第3相試験であるRECOURCE試験の結果から, 日本と欧米諸国で2レジメン以上の治療歴がある切除不能大腸癌患者の標準治療に位置付けられている。TERRA試験は, 上記2試験に参加していないアジア圏におけるトリフルリジン/チピラシル塩酸塩 (FTD/TPI)の有効性と安全性を検証することを目的とし, 中国, 韓国, 及びタイの3か国共同で実施された第3相試験である。
シェーマ
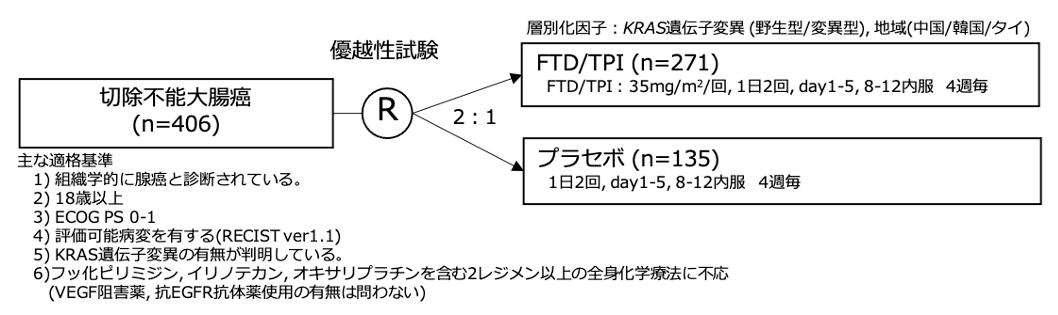
統計学的事項
主要評価項目:全生存期間
本試験はFTD/TPIにより死亡リスクが33%減少 (OSのHR: 0.67) することを検出するよう設計され, 片側αエラー0.025, 検出力90%として, 必要な死亡イベント数は288と算出された。FTD/TPI群:プラセボ群=2 : 1の割付, 試験登録期間, 及び10%程度のフォロー脱落症例が想定されることを鑑みて, 必要症例数は400と設定された。試験結果:
- 中国, 韓国, 及びタイの3か国から406例が登録された(FTD/TPI群 :271例, プラセボ群: 135例)。
- 両群間で患者背景に偏りはなく, 約2/3の症例がKRAS野生型 (FTD/TPI群 :63%, プラセボ群: 63%)であった。
- 前治療として分子標的薬の投与を受けた患者割合 (FTD/TPI群/プラセボ群、以降同様) は45%/51%であった。VEGF阻害薬のみ使用:19%/20%, 抗EGFR抗体薬のみ使用:17%/19%, 両剤とも使用:9%/13%であった。
- 2016年2月16日のデータカットオフ時点で観察された死亡イベント数は316であった。
- 用量強度中央値はFTD/TPI群: 165.6mg/m2/週, プラセボ群:167.8mg/m2/週であった。
- 病勢増悪によるプロトコール中止はFTD/TPI群で224例, プラセボ群で117例であった。
1. 全生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 0.79 (95%C.I. 0.62-0.99) P=0.035 |
|
| FTD/TPI群 | 7.8ヶ月 | 7.1-8.8 | |
| プラセボ群 | 7.1ヶ月 | 5.9-8.2 |
2. 無増悪生存期間(副次評価項目)
| 中央値 | 95%信頼区間 | HR 0.43 (95%C.I. 0.34-0.54) P<0.001 |
|
| FTD/TPI群 | 2.0ヶ月 | 1.9-2.8 | |
| プラセボ群 | 1.8ヶ月 | 1.7-1.8 |
3. 奏効割合, 病勢制御割合(副次評価項目)
| N(%) | 奏効割合 | 病勢制御割合 | |||
|---|---|---|---|---|---|
| FTD/TPI群 | 261(96) | 1.1% | 44.1% | ||
| プラセボ群 | 130(96) | 0% | P=0.554 | 14.6% | P<0.001 |
4. 後治療
| N(%) | VEGF阻害薬 (抗EGFR抗体薬なし) |
抗EGFR抗体薬 (VEGF阻害薬なし) |
VEGF阻害薬/ 抗EGFR抗体薬の両剤 |
殺細胞性抗がん剤 | 治験薬 |
|---|---|---|---|---|---|
| FTD/TPI群 | 27 (10) | 10 (4) | 1 (<1) | 39 (14) | 39 (14) |
| プラセボ群 | 16 (12) | 5 (4) | 1 (1) | 27 (20) | 22 (16) |
5. 有害事象 (CTCAEv4.03, 10%以上の頻度で発生, または全てのGrade3以上の事象)
| FTD/TPI群(n=271) | プラセボ群 (n=135) | |||
|---|---|---|---|---|
| N(%) | 全Grade | Grade≥3 | 全Grade | Grade≥3 |
| 悪心 | 98 (36.2%) | 2 (0.7%) | 15 (11.1%) | 0 |
| 食欲不振 | 67 (24.7%) | 2 (0.7%) | 10 (7.4%) | 0 |
| 疲労 | 55 (20.3%) | 4 (1.5%) | 9 (6.7%) | 0 |
| 嘔吐 | 50 (18.5%) | 2 (0.7%) | 5 (3.7%) | 0 |
| 下痢 | 40 (14.8%) | 2 (0.7%) | 3 (2.2%) | 1 (0.7%) |
| 無力症 | 20 (7.4%) | 2 (0.7%) | 5 (3.7%) | 0 |
| 動悸 | 6 (2.2%) | 1 (0.4%) | 2 (1.5%) | 0 |
| 腹部不快感 | 3 (1.1%) | 1 (0.4%) | 1 (0.7%) | 0 |
| 口腔粘膜炎 | 4 (1.5%) | 1 (0.4%) | 0 | 0 |
| 呼吸困難 | 2 (0.7%) | 0 | 1 (0.7%) | 1 (0.7%) |
| 小腸閉塞 | 3 (1.1%) | 3 (1.1%) | 0 | 0 |
| 上気道感染 | 3 (1.1%) | 1 (0.4%) | 0 | 0 |
| 高血圧 | 2 (0.7%) | 1 (0.4%) | 0 | 0 |
| 浮腫 | 1 (0.4%) | 0 | 1 (0.7%) | 1 (0.7%) |
| 肺臓炎 | 1 (0.4%) | 0 | 1 (0.7%) | 1 (0.7%) |
| 失神 | 1 (0.4%) | 1 (0.4%) | 0 | 0 |
| 貧血 | 209 (77.1%) | 48 (17.7%) | 52 (38.5%) | 8 (5.9%) |
| 白血球数減少 | 190 (70.1%) | 56 (20.7%) | 4 (3.0%) | 0 |
| 好中球数減少 | 182 (67.2%) | 90 (33.2%) | 1 (0.7%) | 0 |
| リンパ球数減少 | 146 (53.9%) | 39 (14.4%) | 34 (25.2%) | 3 (2.2) |
| 血小板数減少 | 96 (35.4%) | 8 (3.0%) | 10 (7.4%) | 2 (1.5) |
| リンパ球増多 | 4 (1.5%) | 1 (0.4%) | 1 (0.7%) | 0 |
| ALP上昇 | 91 (33.6%) | 11 (4.1%) | 58 (43.0%) | 5 (3.7%) |
| 高血糖 | 98 (36.2%) | 7 (2.6%) | 50 (37.0%) | 3 (2.2%) |
| 総ビリルビン上昇 | 99 (36.5%) | 19 (7.0%) | 28 (20.7%) | 10 (7.4%) |
| 低アルブミン血症 | 78 (28.8%) | 8 (3.0%) | 44 (32.6%) | 0 |
| 低ナトリウム血症 | 81 (29.9%) | 12 (4.4%) | 38 (28.1%) | 6 (4.4%) |
| 低カルシウム血症 | 77 (28.4%) | 3 (1.1%) | 33 (24.4%) | 1 (0.7%) |
| AST上昇 | 63 (23.2%) | 10 (3.7%) | 40 (29.6%) | 7 (5.2%) |
| ALT上昇 | 48 (17.7%) | 3 (1.1%) | 29 (21.5%) | 4 (3.0%) |
| 低カリウム血症 | 31 (11.4%) | 2 (0.7%) | 11 (8.1%) | 1 (0.7%) |
| クレアチニン上昇 | 13 (4.8%) | 3 (1.1%) | 10 (7.4%) | 0 |
| 高カリウム血症 | 11 (4.1%) | 1 (0.4%) | 10 (7.4%) | 0 |
| 高カルシウム血症 | 8 (3.0%) | 0 | 1 (0.7%) | 1 (0.7%) |
- 有害事象による治療中止はFTD/TPI群で27例 (10%), プラセボ群で13例 (9.8%) であった。理由としてFTD/TPI群では小腸閉塞, 嘔吐, 疲労が, プラセボ群では食欲不振が最多であった。
- FTD/TPI群の23例 (8.5%) , プラセボ群の1例 (0.7%) が少なくとも一段階の減量を要した。
- 4-7日間の投与延期は, FTD/TPI群で77例 (33.2%) ,プラセボ群で5例 (4.5%) , 8日間以上の投与延期はFTD/TPI群で33例 (14.2%) , プラセボ群で2例 (1.8%)で認められた。
- 治療期間中の死亡はFTD/TPI群で5例 (1.8%) , プラセボ群で1例 (0.7%)であり, いずれも試験治療との関連はなかった。
結語
FTD/TPIはアジア人の切除不能大腸癌患者においてもOS及びPFSを統計学的に有意に改善した。安全性プロファイルは既報と同様であった。
執筆:北海道大学病院 消化器内科 特任助教 原田 一顕 先生
監修:愛知県がんセンター病院 薬物療法部 医長 舛石 俊樹 先生
監修:愛知県がんセンター病院 薬物療法部 医長 舛石 俊樹 先生