| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 二次治療 | 第2相試験 | 無増悪生存期間 | global | なし |
試験名 :SPIRITT
レジメン:FOLFIRI+パニツムマブ vs FOLFIRI+ベバシズマブ
登録期間:2006年11月〜2010年12月
背景
米国での切除不能大腸癌に対する治療では、ベバシズマブ(BEV)は一次治療としてオキサリプラチンを含むレジメンと併用して最も多く選択され、抗EGFR抗体薬は、二次治療としてイリノテカンを含むレジメンでより頻繁に使用されていた(本試験開発当時)。パニツムマブ(PANI)はEGFRを標的とするヒト型モノクローナル抗体であり、20050181試験1)においてKRAS 野生型の切除不能大腸癌への二次治療としてFOLFIRIとの併用で無増悪生存期間の延長効果が報告された。本試験は、一次治療でオキサリプラチンとBEVを含むレジメンが選択されたKRAS 野生型の切除不能大腸癌を対象に、二次治療としてのFOLFIRI+BEVに対するFOLFIRI+PANIの有効性を検討した、非盲検ランダム化多施設共同第2相試験である。
シェーマ
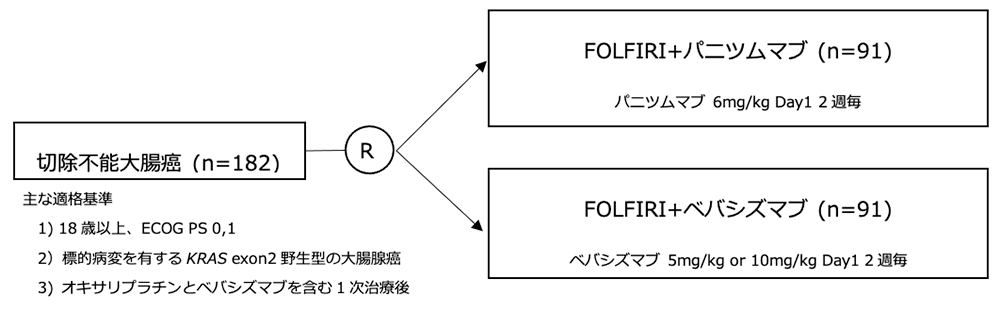
統計学的事項
本試験は当初、KRAS exon2の遺伝子プロファイルに関係なく切除不能大腸癌を対象とした研究として計画された。その後にKRAS変異と抗EGFR抗体薬の効果の関連が判明し、KRAS exon2野生型の切除不能大腸癌のみを対象とし、BEVに対するPANI併用療法の無増悪生存期間における優越性を仮説としてプロトコールが修正された。しかし、20050181試験の結果が公表されて、前述の設定ではPFSの差を検出できないことが見積もられたため、推定研究へとプロトコールは再度修正された。したがって、正式な統計的仮説は設定されておらず、本試験の治療効果の推定値はすべて記述的である。
無増悪生存期間のハザード比の両側95%信頼区間の最大半値幅が0.39を超えないように設定され、約100例のKRAS exon2野生型大腸癌が必要と算出された。
主要評価項目:無増悪生存期間
(2回目のプロトコール修正でのサンプルサイズの設定)無増悪生存期間のハザード比の両側95%信頼区間の最大半値幅が0.39を超えないように設定され、約100例のKRAS exon2野生型大腸癌が必要と算出された。
試験結果:
- KRAS exon2の遺伝子プロファイルと関係なく266例が集積され、うち84例はKRAS exon2変異型であったために除外され、182例がFOLFIRI+PANI群(91例)とFOLFIRI+BEV群(91例)に割付けられた。
- FOLFIRI+PANI群で65歳以上 (36/91例[40%] vs 28/91例[31%])、75歳以上(10/91例[11%] vs 5/91 [5%])、結腸癌(69/91[76%] vs 61/91例[67%])、転移臓器が2臓器以上(59/91例[65%] vs 45/91例[49%])がFOLFIRI+BEV群より多かった。
- PANIの投与回数の中央値は8回(1-51回)、用量強度の平均値は84%だった。
- BEVの投与回数の中央値は10回(1-38回)、用量強度の平均値は88%だった。
- イリノテカンの用量強度平均値と投与回数中央値はPANI群で86%と8回、BEV群で85%と9回だった。
- 持続静注5-FUの用量強度と投与回数中央値はPANI群で76%と8回、BEV群で72%と11回だった。
- 急速静注5-FUの用量強度と投与回数中央値はPANI群で86%と8回、BEV群で85%と9回だった。
1. 無増悪生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 1.01 (95%CI 0.68-1.50) P=0.97 |
|
| FOLFIRI+PANI群 | 7.7ヶ月 | 5.7-11.8か月 | |
| FOLFIRI+BEV群 | 9.2ヶ月 | 7.8-10.6か月 |
- 無増悪生存期間に対するCOX比例ハザードによる背景因子のサブグループ解析では、治療群間の相対的な差異を認めなかった。
2. 全生存期間
| 中央値 | 95%信頼区間 | HR 1.06 (95%CI 0.75-1.49) P=0.75 |
|
| FOLFIRI+PANI群 | 18.0ヶ月 | 13.5-21.7か月 | |
| FOLFIRI+BEV群 | 21.4ヶ月 | 16.5-24.6か月 |
- 全生存期間に対するCOX比例ハザードによる背景因子のサブグループ解析では、治療群間の相対的な差異を認めなかった。
3. 奏効割合
| 奏効割合 | 95%信頼区間 | OR 1.57 (95%CI 1.29-1.91) P<0.001 |
|
| FOLFIRI+PANI群 | 32% (28/91例) | 23-43% | |
| FOLFIRI+BEV群 | 19% (16/91例) | 11-29% |
- FOLFIRI+PANI群でCR 1例(1%)、PR 27例(31%)、SD 35例(40%)、PD 12例(14%)が観察され、FOLFIRI+BEV群でCR 0例、PR 16例(19%)、SD 50例(60%)、PD 11例(13%)が観察された。
4. 3次治療での分子標的治療薬の使用状況
| FOLFIRI+PANI群 91例 | FOLFIRI+BEV群 91例 | |
|---|---|---|
| 抗EGFR抗体薬使用割合 | 26% (24例) | 54% (49例) |
| 抗EGFR抗体薬使用期間中央値 | 10.9ヶ月 | 8.3か月 |
| 抗VEGF抗体薬使用割合 | 20% (18例) | 24% (22例) |
| 抗VEGF抗体薬使用期間中央値 | 7.9か月 | 9.7か月 |
| 分子標的治療薬使用割合 | 57% (52例) | 75% (68例) |
5. 有害事象
| FOLFIRI+PANI群 91例 | FOLFIRI+BEV群 91例 | |||
|---|---|---|---|---|
| 全Grade | Grade 3/4 | 全Grade | Grade 3/4 | |
| 全有害事象 | 91 (100%) | 71 (78%) | 90 (99%) | 59 (65%) |
| 皮膚障害 | 83 (91%) | 27 (30%) | 51 (56%) | 2 (2%) |
| 下痢 | 68 (75%) | 18 (20%) | 63 (69%) | 2 (2%) |
| 低マグネシウム血症 | 39 (43%) | 12 (13%) | 12 (13%) | 0 (0%) |
| 好中球数減少 | 34 (37%) | 21 (23%) | 43 (47%) | 27 (30%) |
| 低カリウム血症 | 32 (35%) | 13 (14%) | 17 (19%) | 5 (5%) |
| 脱水 | 27 (30%) | 9 (10%) | 21 (23%) | 4 (4%) |
| 低血圧 | 16 (18%) | 5 (5%) | 5 (5%) | 0 (0%) |
| 肺塞栓 | 9 (10%) | 8 (9%) | 2 (2%) | 2 (2%) |
| 深部静脈血栓症 | 7 (8%) | 5 (5%) | 2 (2%) | 0 (0%) |
| 高血圧 | 2 (2%) | 0 (0%) | 9 (10%) | 4 (4%) |
| 蛋白尿 | 0 (0%) | 0 (0%) | 8 (9%) | 1 (1%) |
- 治療中止に至った有害事象はPANI群で26例(29%)、BEV群で23例(25%)だった。
- infusion reactionはPANI群で4例(4%)、BEV群で8例(9%)だった。
- 各群でGrade 5の有害事象が6例ずつ発生した。
結語
オキサリプラチンとBEVを含む一次治療後の切除不能大腸癌において、二次治療としてFOLFIRIと併用する分子標的治療薬としてPANIとBEVは同程度の有効性と許容できる範囲内の有害事象が観察された。抗EGFR抗体薬と抗VEGF抗体薬の2種類の分子標的治療薬を選択する際の参考となるバイオマーカーの開発が望まれる。
関連論文
1) Peeters M, Price TJ, Cervantes A, et al. Randomized phase III study of panitumumab with fluorouracil, leucovorin, and irinotecan (FOLFIRI) compared with FOLFIRI alone as second-line treatment in patients with metastatic colorectal cancer. J Clin Oncol 2010; 28:4706-13. [Pubmed]
執筆:九州がんセンター 消化管外科 中島 雄一郎 先生
監修:愛知県がんセンター病院 薬物療法部 医長 坂東 英明 先生
監修:愛知県がんセンター病院 薬物療法部 医長 坂東 英明 先生