| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 胃癌術後 (pStage II/IIIA/IIIB) |
術後補助化学療法 | 第3相 | 無病生存期間 | 韓国・中国・台湾 | なし |
試験名 :CLASSIC
レジメン:手術単独 vs 手術+術後補助化学療法(XELOX)
登録期間:2006年6月〜2009年6月
背景
切除可能胃癌に対しては、D2リンパ節郭清を伴う胃切除術が欧米並びに東アジア諸国におけるガイドラインで推奨されている。
根治術後の術後補助化学療法は患者の予後を改善し、切除可能胃癌症例の標準的治療とされているが、地域によって推奨治療が異なっており、米国では術後補助化学放射線療法が、イギリスと欧州の一部では周術期化学療法(術前後)が、そして日本ではACTS-GC試験の結果より術後補助化学療法が推奨治療となっている。
D2リンパ節郭清を伴う胃切除術が広がるにつれ、切除可能胃癌症例に対するD2リンパ節郭清を伴う胃切除術後の最適な術後補助化学療法が何かという問いが生じてきた。そこで、本試験ではD2リンパ節郭清を伴う胃切除術が施行されたpStage II/IIIA/IIIB (AJCC/UICC 6th)の胃腺癌症例を対象とし、手術単独に対してXELOXによる術後補助化学療法が無病生存期間を延長するかが検証された。
根治術後の術後補助化学療法は患者の予後を改善し、切除可能胃癌症例の標準的治療とされているが、地域によって推奨治療が異なっており、米国では術後補助化学放射線療法が、イギリスと欧州の一部では周術期化学療法(術前後)が、そして日本ではACTS-GC試験の結果より術後補助化学療法が推奨治療となっている。
D2リンパ節郭清を伴う胃切除術が広がるにつれ、切除可能胃癌症例に対するD2リンパ節郭清を伴う胃切除術後の最適な術後補助化学療法が何かという問いが生じてきた。そこで、本試験ではD2リンパ節郭清を伴う胃切除術が施行されたpStage II/IIIA/IIIB (AJCC/UICC 6th)の胃腺癌症例を対象とし、手術単独に対してXELOXによる術後補助化学療法が無病生存期間を延長するかが検証された。
シェーマ
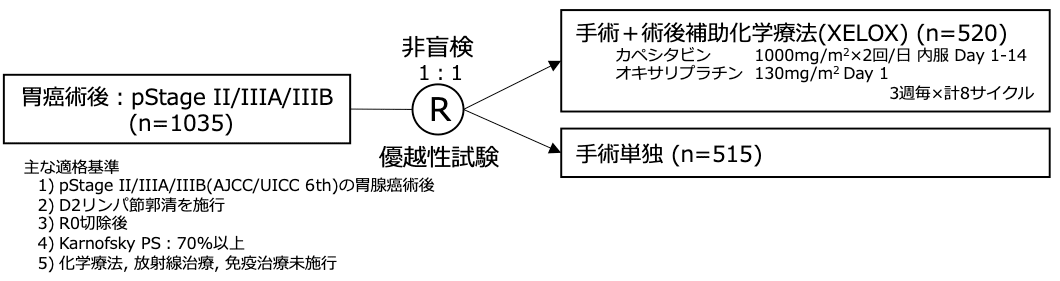
統計学的事項
主要評価項目:無病生存期間
本試験は術後補助化学療法群(XELOX)及び手術単独群の3年無病生存割合がそれぞれ65.0%、56.2%となることを想定し(HR=0.75)、検出力80%、両側α=0.05として、各群512例の登録と385イベントが必要と設定された。本試験では257イベント(必要イベントの66.8%)が生じた段階で、中間解析が予定された。
試験結果:
- 2006年6月から2009年6月までの間に1,035例(手術単独群 515例/XELOX群 520例)が無作為割り付けされた。
- 無病生存期間に関して、257イベントが発生した時点で予定の中間解析が実施され、試験終了となった。この段階での観察期間中央値は手術単独群 34.3ヶ月(25.6-41.9)、XELOX群 34.2ヶ月(25.4-41.7)であった。
- 患者背景:両群間でバランスがとれていた。
1. 無病生存期間 (主要評価項目)
| イベント数 | 3年無病生存割合 | 95%信頼区間 | HR 0.56 (95%C.I. 0.44-0.72), p<0.0001 | |
| 手術単独群 | 163 (32%) | 59% | 53-64 | |
| XELOX群 | 106 (20%) | 74% | 69-79 |
2. 全生存期間
| イベント数 | 3年無病生存割合 | 95%信頼区間 | HR 0.72 (95%C.I. 0.52-1.00), p=0.0493 | |
| 手術単独群 | 85 (17%) | 78% | 74-83 | |
| XELOX群 | 65 (13%) | 83% | 79-87 |
3. 再発形式
| 再発例数 | 腹膜再発 | 局所再発 | 遠隔再発 | |
|---|---|---|---|---|
| 手術単独群 | 155 (30%) | 56 | 44 | 78 |
| XELOX群 | 96 (18%) | 47 | 21 | 49 |
4. サブ解析:病期/リンパ節転移状況による無病生存期間 (3年無病生存割合)
| pStage | 症例数 | 手術単独群 | 95%信頼区間 | XELOX群 | 95%信頼区間 | HR | 95%信頼区間 |
|---|---|---|---|---|---|---|---|
| II | 515 | 71% | 64-78 | 85% | 79-90 | 0.55 | 0.36-0.84 |
| IIIA | 377 | 51% | 42-60 | 66% | 57-75 | 0.57 | 0.39-0.82 |
| IIIB | 143 | 33% | 15-51 | 61% | 48-73 | 0.57 | 0.35-0.95 |
- 全病期において、手術単独と比較し、術後補助化学療法群で有意な生存延長を認めた。
| リンパ節転移 | 症例数 | HR | 95%信頼区間 |
|---|---|---|---|
| N0 | 103 | 0.90 | 0.41-1.97 |
| N1 | 632 | 0.63 | 0.44-0.89 |
| N2 | 311 | 0.45 | 0.36-0.66 |
- リンパ節転移に関しては、N1-2では手術単独と比較し、術後補助化学療法群(XELOX群)で有意な生存延長を認めたが、N0では生存延長を示さなかった。
5. 有害事象 (CTCAE ver.3.0)
- 安全性情報がない症例や術後補助化学療法群(XELOX群)で実際に投与を受けなかった症例など61例が安全性解析から除外された。
- また、手術単独群に割り付けられた症例で誤って術後補助化学療法を受けた1例は、術後補助化学療法群(XELOX群)の安全性解析に含まれた。
- 最終的に術後補助化学療法群(XELOX群) 496例、手術単独群 478例が安全性解析対象となった。
| N (%) | 手術単独群 (n=478) | XELOX群 (n=496) | ||
|---|---|---|---|---|
| 全Grade | Grade 3/4 | 全Grade | Grade 3/4 | |
| 1つ以上の有害事象発現 | 253 (53) | 30 (6) | 490 (99) | 279 (56) |
| 悪心 | 20 (4) | 0 (0) | 326 (66) | 39 (8) |
| 好中球数減少 | 4 (<1) | 1 (<1) | 300 (60) | 107 (22) |
| 食欲不振 | 18 (4) | 1 (<1) | 294 (59) | 23 (5) |
| 末梢神経障害 | 0 (0) | 0 (0) | 277 (56) | 12 (2) |
| 下痢 | 52 (11) | 1 (<1) | 236 (48) | 9 (2) |
| 嘔吐 | 16 (3) | 0 (0) | 191 (39) | 37 (7) |
| 疲労 | 11 (2) | 0 (0) | 156 (31) | 23 (5) |
| 血小板数減少 | 0 (0) | 0 (0) | 130 (26) | 40 (8) |
| 手足の皮膚反応 | 0 (0) | 0 (0) | 93 (19) | 5 (1) |
- 43例(9%)に化学療法に起因する重篤な有害事象が発現した。
- 術後補助化学療法群(XELOX群)の1例は敗血症(化学療法と関連あり)、もう1例は転移性病変(化学療法と関連なし)によって最終投与後28日以内に死亡した。
- 手術単独群の1例は観察期間に心不全で死亡した。
6. 投与状況
- 術後補助化学療法群(XELOX群)で予定された8サイクルの治療を受けた症例は346例(67%)。
- 167例でカペシタビンの減量、147例で休薬、369例で投与延期を生じた。
- 相対用量強度中央値はカペシタビン 85%、オキサリプラチン 98%であった。
- 有害事象で投与中止となった症例は50例(10%)であり、主な理由は好中球数減少(17例, 3%)、血小板数減少(5例, 1%)、嘔吐(5例, 1%)であった。
結語
本試験結果から、D2リンパ節郭清を伴う治癒切除後胃腺癌の術後補助化学療法としてカペシタビン+オキサリプラチン併用療法(XELOX療法)は新たな治療選択肢となり得る。
執筆:釧路ろうさい病院 腫瘍内科 部長 原田 一顕 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生
監修:北海道大学病院 消化器内科 助教 結城 敏志 先生