| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 肝細胞癌 | 一次治療 | 第1b相 | DLT評価および奏効割合 | 国際 | あり |
試験名 :なし
レジメン:レンバチニブ+ペムブロリズマブ
登録期間:2017年2月27日〜2019年4月11日
背景
レンバチニブは、肝細胞癌に対してREFLECT試験においてソラフェニブに対する全生存期間の非劣性が示されている。また、ペムブロリズマブ(Pembro)は、KEYNOTE-240で肝細胞癌に対する二次治療としての有効性が検討された。プラセボと比べて、統計学的に生存期間の延長は認めず、有効性は示せなかったが、良好な無増悪生存期間が報告されており、Pembroは肝細胞がんに対して一定の効果を有すると考えられている。前臨床試験の結果、肝細胞癌に対するレンバチニブ+Pembro併用療法の有効性が期待されており、本試験が行われた。
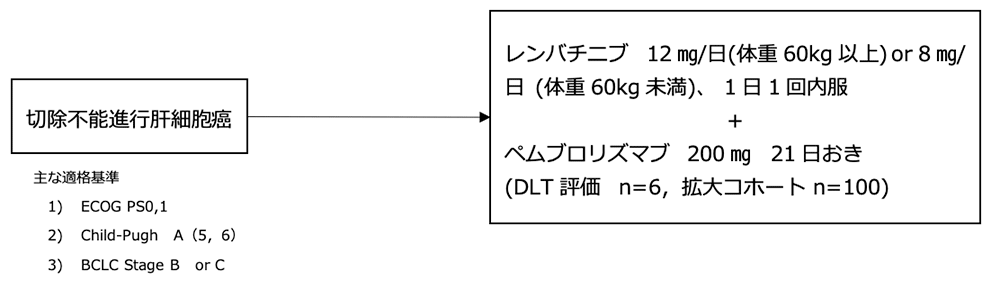
シェーマ
統計学的事項
主要評価項目:
DLT(用量制限毒性)評価パート:忍容性拡大パート:客観的奏効割合、奏効持続期間
DLT評価パートののちに、2度の中間分析を行い、試験の継続判断を行った。
閾値奏効割合を25%、期待奏効割合を45%と仮定し、100例の登録した場合、検出力96%、両側α=0.02となる。最初の中間分析(N = 20)で5例以上の奏効が得られた場合、36例の追加登録を行い、 2度目の中間分析(N = 56)で16例以上の奏効が得られた場合、約44例の追加登録が行われた。
試験結果:
- 6人を対象にしたDLT評価パートではDLTを認めず、レンバチニブ 12㎎/日or 8㎎/日 1日1回内服とPembro 200㎎ 21日ごとの併用療法の忍容性が確認され、拡大パートに移行した。
- 拡大パートでは初回薬物療法例を対象としたため、DLT評価パートで初回薬物療法であった2例を含む計100例を対象に、拡大パートが実施され、有効性と安全性が評価された。
- 追跡期間中央値は10.6ヶ月であった。
- データカットオフ時点で患者の37%が治療継続中であった。
1. 奏効割合(主要評価項目)
| 中央値 | 95%信頼区間 | |
|---|---|---|
| mRECIST(画像中央判定) | 46.0% | 36%‐56.3% |
| mRECIST(責任医師判定) | 41.0% | 31.3%⁻51.3% |
| RECIST v1.1(画像中央判定) | 36.0% | 26.6%‐46.2% |
2. 奏効持続期間(主要評価項目)
| 中央値 | 95%信頼区間 | |
|---|---|---|
| mRECIST(画像中央判定) | 8.6ヶ月 | 6.9ヶ月-未到達 |
| mRECIST(責任医師判定) | 12.6ヶ月 | 6.2ヶ月-18.7ヶ月 |
| RECIST v1.1(画像中央判定) | 12.6ヶ月 | 6.9ヶ月-未到達 |
3. 無増悪生存期間
| 中央値 | 95%信頼区間 | |
|---|---|---|
| mRECIST(画像中央判定) | 9.3ヶ月 | 5.6ヶ月-9.7ヶ月 |
| mRECIST(責任医師判定) | 8.2ヶ月 | 7.4ヶ月-9.7ヶ月 |
| RECIST v1.1(画像中央判定) | 8.6ヶ月 | 7.1ヶ月-9.7ヶ月 |
4. 全生存期間
| 中央値 | 95%信頼区間 | |
|---|---|---|
| 22.0ヶ月 | 20.4ヶ月-未到達 |
5. 有害事象
| N(%)(N=100) | ||||
|---|---|---|---|---|
| Grade 1 | Grade 2 | Grade 3 | Any Grade | |
| 高血圧 | 1(1) | 18(18) | 17(17) | 36(36) |
| 下痢 | 19(19) | 11(11) | 5(5) | 35(35) |
| 疲労 | 12(12) | 14(14) | 4(4) | 30(30) |
| 食欲減退 | 12(12) | 16(16) | 0 | 28(28) |
| 甲状腺機能低下 | 11(11) | 14(14) | 0 | 25(25) |
| 手足症候群 | 13(13) | 9(9) | 1(1) | 23(23) |
| 体重減少 | 8(11) | 11(11) | 3(3) | 22(22) |
| 発声障害 | 19(19) | 1(1) | 1(1) | 21(21) |
| AST上昇 | 4(4) | 5(5) | 11(11) | 20(20) |
| タンパク尿 | 9(9) | 7(7) | 4(4) | 20(20) |
| 無力症 | 4(4) | 10(10) | 5(5) | 19(19) |
| 悪心 | 10(10) | 6(6) | 1(1) | 17(17) |
| 皮疹 | 11(11) | 3(3) | 1(1) | 15(15) |
結語
レンバチニブ+Pembro併用療法は切除不能肝細胞癌に対して有望な抗腫瘍効果を示した。有害事象も管理可能な範囲であった。現在、切除不能肝細胞癌の初回薬物療法例を対象として、レンバチニブ+ Pembroとレンバチニブ+プラセボを比較した二重盲検ランダム化第3相試験(LEAP-002)が進行中であり、その結果が待たれる状況である。
執筆:国立がん研究センター中央病院 肝胆膵内科 医員 丸木 雄太 先生
監修:国立がん研究センター東病院 肝胆膵内科 科長 池田 公史 先生
監修:国立がん研究センター東病院 肝胆膵内科 科長 池田 公史 先生