| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 一次治療 | 第3相 | 無増悪生存期間 | 国内 | あり |
試験名 :SOFT
レジメン:SOX+BEV vs mFOLFOX6+BEV
登録期間:2009年2月〜2011年3月
背景
FOLFOX(5-FU/LV+オキサリプラチン)+ベバシズマブ(BEV)およびFOLFIRI(5-FU/LV+イリノテカン)+BEVは切除不能進行再発大腸癌における一次治療として広く用いられている。CAPOX(カペシタビン+オキサリプラチン)+BEVはFOLFOX+BEVに対して無増悪生存期間における非劣性が第3相試験(NO16966)で示された。S-1は5-FUのプロドラッグであるテガフール、血中の5-FU濃度を長期間維持するギメラシル、胃腸組織における5-FUの毒性を抑制するオテラシルの合剤であり、切除不能進行再発大腸癌二次治療において、IRIS(イリノテカン+S-1)はFOLFIRIに対して全生存期間における非劣性が第3相試験(FIRIS)で示された。一次治療としてのSOX (S-1+オキサリプラチン)は無増悪生存期間中央値が6.4ヶ月、8.5ヶ月と良好であることが報告され、SOXのCAPOXに対する非劣性が第3相試験で示されたことから、S-1は一次治療の新しい選択肢となった。一次治療におけるSOX+BEVのmFOLFOX6+BEVに対する非劣性を検証する目的に第3相試験(SOFT)を実施した。
シェーマ
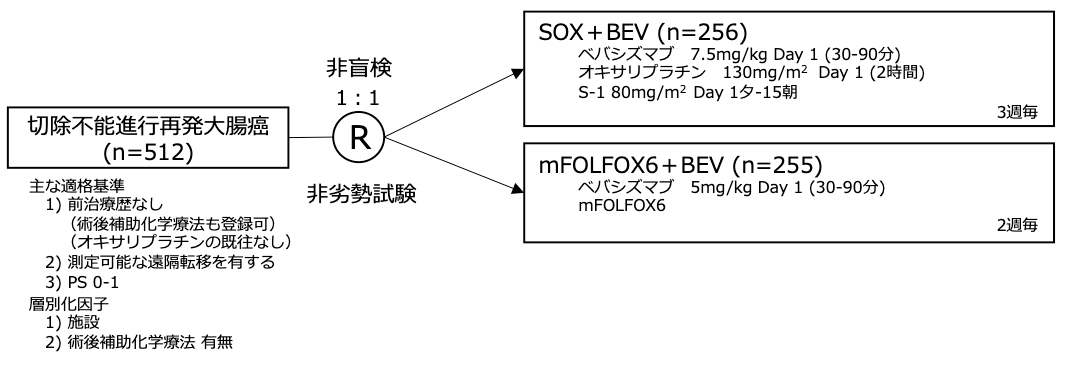
統計学的事項
主要評価項目:無増悪生存期間
mFOLFOX6+BEV群を対照としてSOX+BEV群の非劣勢を検証(非劣性マージン HR 1.33、両側α=0.05、検出力=80%)必要イベント数は計388イベント、必要症例数は計500例。
試験結果:
- 2009年2月1日〜2011年3月31日の間に日本の82施設より512例が登録された。
- 299例が登録された時点で、SOX+BEV群において4例の消化管穿孔を認め登録は一時中断された。IDMCの勧告に従い、内視鏡の通過を妨げるような高度原発巣狭窄例、画像上確認できる腹膜播種を有する症例を除外基準に追加し登録を再開した。
- データカットオフは2012年6月30日。
- mFOLFOX6+BEVに割り当てられた1例は、無作為化後に大腸癌ではないと判定されたため、無増悪生存期間における解析から除外された。
- 安全性解析対象集団のmFOLFOX6+BEV 10例、SOX+BEV 1例はBEVが投与されなかった。
- 患者背景は両群で隔たりはなかった。
- 無増悪生存期間の解析時点の観察期間中央値は18.4ヶ月(四分位範囲13.1-24.9)で、413のイベントが確認された。
1. 無増悪生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR 1.04 (95%C.I. 0.86-1.27) 非劣勢マージン1.33 P = 0.014 |
|
| SOX+BEV | 11.5ヶ月 | 10.7-13.2 | |
| mFOLFOX6+BEV | 11.7ヶ月 | 10.7-12.9 |
2. 全生存期間
| 中央値 | 95%信頼区間 | |
| SOX+BEV | 29.6ヶ月 | 28.8-NE |
| mFOLFOX6+BEV | 30.9ヶ月 | 28.6-33.1 |
NE: not estimated
3. 奏効割合・病勢制御割合
| 奏効割合/病勢制御割合 | |
|---|---|
| SOX+BEV | 62%/89% (CR 4, PR 140, SD 65, PD 4例) |
| mFOLFOX6+BEV | 63%/89% (CR 7, PR 139, SD 62, PD 9例) |
4. 転移巣切除割合
| 割合 | P = 0.77 | |
| SOX+BEV | 9%(24例) | |
| mFOLFOX6+BEV | 9%(22例) |
5. 治療成功期間(治療中または治療終了後、増悪なく生存)
| 中央値 | 95%信頼区間 | |
|---|---|---|
| SOX+BEV | 6.2ヶ月 | 5.7-7.1 |
| mFOLFOX6+BEV | 6.7ヶ月 | 5.9-7.6 |
6. 相対用量強度(Relative dose intensity)
| 中央値 | 95%信頼区間 | |
|---|---|---|
| SOX+BEV (n=250) | ||
| S-1 | 79.9% | 68.8-93.7 |
| オキサリプラチン | 75.5% | 56.6-92.6 |
| ベバシズマブ | 88.5% | 77.1-96.0 |
| mFOLFOX6+BEV (n=249) | ||
| 5-FU急速静注 | 75.0% | 61.6-90.3 |
| 5-FU持続点滴 | 79.0% | 68.0-90.9 |
| ロイコボリン | 87.3% | 78.1-93.9 |
| オキサリプラチン | 62.7% | 48.4-84.6 |
| ベバシズマブ | 83.4% | 71.4-91.7 |
7. 減量が必要だった症例数とオキサリプラチンの再投与を行った症例数
| 減量例数 | オキサリプラチン再投与例数 | |
|---|---|---|
| SOX+BEV | ||
| S-1 | 133例(53%) | - |
| オキサリプラチン | 132例(53%) | 14/60例(23%) |
| mFOLFOX6+BEV | ||
| 5-FU | 146例(59%) | - |
| オキサリプラチン | 143例(57%) | 15/81例(19%) |
8. 有害事象
| SOX+BEV (n=250) |
mFOLFOX6+BEV (n=249) |
P (Grade 3以上) |
|||
|---|---|---|---|---|---|
| 全Grade | ≧Grade 3 | 全Grade | ≧Grade 3 | ||
| 白血球減少 | 145 (58%) | 6 (2%) | 175 (70%) | 21 (8%) | 0.0029 |
| 好中球減少 | 148 (59%) | 22 (9%) | 180 (72%) | 84 (34%) | <0.0001 |
| 血小板減少 | 175 (70%) | 9 (4%) | 135 (54%) | 2 (1%) | 0.063 |
| 貧血 | 98 (39%) | 13 (5%) | 99 (40%) | 6 (2%) | 0.16 |
| AST増加 | 138 (55%) | 11 (4%) | 107 (43%) | 8 (3%) | 0.64 |
| ALT増加 | 98 (39%) | 12 (5%) | 99 (40%) | 8 (3%) | 0.49 |
| クレアチニン増加 | 26 (10%) | 0 (0%) | 37 (15%) | 0 (0%) | - |
| 蛋白尿 | 115 (46%) | 0 (0%) | 120 (48%) | 0 (0%) | - |
| 口腔粘膜炎・口内炎 | 103 (41%) | 4 (2%) | 123 (49%) | 0 (0%) | 0.12 |
| 食思不振 | 160 (64%) | 13 (5%) | 160 (64%) | 3 (1%) | 0.019 |
| 悪心 | 130 (52%) | 5 (2%) | 139 (56%) | 3 (1%) | 0.72 |
| 嘔吐 | 51 (20%) | 2 (1%) | 50 (20%) | 1 (<1%) | 1.00 |
| 下痢 | 133 (53%) | 23 (9%) | 96 (39%) | 7 (3%) | 0.004 |
| 皮疹 | 55 (22%) | 0 (0%) | 58 (23%) | 0 (0%) | - |
| 色素過剰 | 125 (50%) | - | 96 (39%) | - | - |
| 倦怠感 | 140 (56%) | 7 (3%) | 134 (54%) | 3 (1%) | 0.34 |
| 感覚ニューロパチー | 228 (91%) | 25 (10%) | 224 (90%) | 35 (14%) | 0.17 |
| 高血圧 | 65 (26%) | 15 (6%) | 76 (31%) | 14 (6%) | 1.00 |
| 高ビリルビン血症 | 33 (13%) | 5 (2%) | 10 (4%) | 1 (<1%) | 0.22 |
| 脱毛症 | 15 (6%) | - | 61 (24%) | - | - |
| インフュージョンリアクション | 11 (4%) | 0 (0%) | 1 (<1%) | 0 (0%) | - |
| 手足症候群 | 39 (16%) | 1 (<1%) | 44 (18%) | 0 (0%) | 1.00 |
| 麻痺性イレウス | 9 (4%) | 7 (3%) | 7 (3%) | 7 (3%) | 1.00 |
| 消化管穿孔 | 5 (2%) | 5 (2%) | 1 (<1%) | 1 (<1%) | 0.22 |
| 発熱 | 38 (15%) | 0 (0%) | 44 (18%) | 0 (0%) | - |
| 発熱性好中球減少 | 0 (0%) | 0 (0%) | 1 (<1%) | 1 (<1%) | 0.50 |
| 流涙 | 12 (5%) | 0 (0%) | 4 (2%) | 0 (0%) | - |
| 血栓症 | 3 (1%) | 2 (1%) | 7 (3%) | 4 (2%) | 0.45 |
SOX+BEV療法における治療開始前クレアチニンクリアランスと≧Grade 3の下痢の頻度
| クレアチニンクリアランス | 例数* | 下痢≧Grade 3 |
|---|---|---|
| <1.17 mL/s | 57 | 12(21%) |
| ≧1.17 mL/s | 192 | 11(6%) |
*クレアチニンクリアランスのデータ未収集 1例
9. 治療関連死亡
| 例数 | |
|---|---|
| SOX+BEV | 4例 |
| mFOLFOX6+BEV | 3例 |
10. 治療中止理由
| SOX+BEV (n=246) |
mFOLFOX6+BEV (n=247) |
|
|---|---|---|
| 増悪 | 95 (38%) | 95 (38%) |
| 腫瘍縮小にともなう手術 | 28 (11%) | 25 (10%) |
| 有害事象 | 125 (51%) | 127 (51%) |
11. 二次治療移行
| 例数 | |
|---|---|
| SOX+BEV | 198 |
| mFOLFOX6+BEV | 188 |
結語
切除不能進行再発大腸癌に対する初回治療として、SOX+BEVはmFOLFOX6+BEVに対する無増悪生存期間の非劣勢が証明されたことから、アジア人における標準治療となり得る。SOX+BEVの安全性は患者教育、最適な支持療法、外来でのサポートシステムの確立、治療前腎機能による個別化治療によりさらに改善できるだろう。
執筆:静岡県立静岡がんセンター 消化器内科 レジデント 瀧浪 将貴 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生