大腸癌 NO16966(CAPOX vs FOLFOX)
Randomized phase III study of capecitabine plus oxaliplatin compared with fluorouracil/folinic acid plus oxaliplatin as first-line therapy for metastatic colorectal cancer
Cassidy J, Clarke S, Díaz-Rubio E, et al. J Clin Oncol. 2008; 26: 2006-12. [PubMed]

| 対象疾患 |
治療ライン |
研究の相 |
主要評価項目 |
実施地域 |
日本の参加 |
| 大腸癌 |
一次治療 |
第3相 |
無増悪生存期間 |
国際 |
なし |
試験名 :NO16966(CAPOX vs FOLFOX)
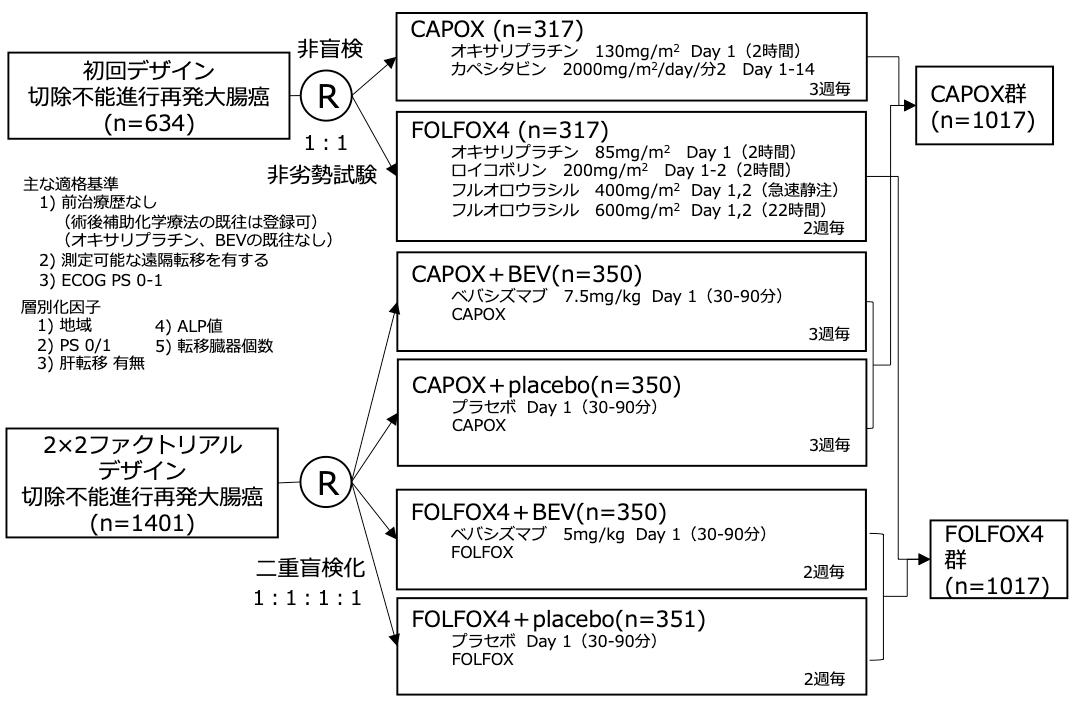
レジメン:CAPOX(+BEV or placebo) vs FOLFOX(+BEV or placebo) 、2×2ファクトリアルデザイン
登録期間:2003年6月〜2005年2月
FOLFOX4(急速静注/持続静注5-FU/LV+オキサリプラチン)は切除不能進行再発大腸癌に広く用いられる。カペシタビンは経口フッ化ピリミジン系薬剤であり、切除不能進行再発大腸癌の初回治療またはstage III結腸癌の術後補助化学療法として、急速静注5-FU/LVと同程度の有用性が示された。CAPOX(カペシタビン+オキサリプラチン)は奏効割合55%、全生存期間中央値19.5ヶ月と良好な結果が第2相試験で示された。当初、本試験はFOLFOX4に対するCAPOXの非劣勢を検証するための第3相試験(NO16966A)として開始されたが、 2003年6月に
AVF2107g試験の結果が公表されたことから、FOLFOX vs CAPOXとBEV vs Placeboの2x2ファクトリアルデザインに変更し(NO16966) 、一次治療におけるFOLFOXに対するCAPOXの無増悪生存期間における非劣性に加え、FOLFOXまたはCAPOXに対するBEV併用療法の有用性を検証することとなった。
シェーマ
主要評価項目:無増悪生存期間
FOLFOX4群を対照としてCAPOX群が非劣勢を検証(非劣勢マージン HR 1.23、両側α=0.025 、検出力=90%)。最終解析は1200イベントに達した時点で実施。
同時に、Placebo群を対照としてBEV群の優越性を検証(ハザード比 0.75、片側α=0.025 、検出力=98%、必要イベント数 985)。
試験結果:
- 2003年6月〜2004年5月の間に634例が初回デザインパートに、2004年2月~2005年2月の間に1401例が2x2ファクトリアルデザインパートに登録された。
- 1例は誤って2回割り付けがされ、解析ではCAPOX+placebo群に含まれた。
- ITT解析対象集団は2034例(欧州1048例、カナダ343例、オセアニア188例、米国178例、アジア163例、南米65例、南アフリカ49例)。適格例は計1904例。安全性解析対象集団はplacebo群1304例、BEV群694例。
- 患者背景は両群で隔たりはなかった。
- 無増悪生存期間におけるデータカットオフは2006年1月31日、観察期間中央値は17.7ヶ月。
- 全生存期間におけるデータカットオフは2007年1月31日、観察期間中央値は29.7ヶ月。
1. 無増悪生存期間(ITT) (主要評価項目)
| |
中央値 |
HR 1.04 (97.5%C.I. 0.93-1.16) |
| CAPOX群 |
8.0ヶ月 |
| FOLFOX4群 |
8.5ヶ月 |
2. 奏効割合(担当医評価)
| |
奏効割合 |
HR 0.94 (97.5%C.I. 0.77-1.15) |
| CAPOX群 |
47% |
| FOLFOX4群 |
48% |
3. 全生存期間(ITT)
| |
中央値 |
HR 0.99 (97.5%C.I. 0.88-1.12) |
| CAPOX群 |
19.8ヶ月 |
| FOLFOX4群 |
19.6ヶ月 |
4. サブグループの無増悪生存期間(ITT)
| |
中央値 |
HR 1.01 (97.5%C.I. 0.83-1.23) |
| CAPOX+BEV |
9.3ヶ月 |
| FOLFOX4+BEV |
9.4ヶ月 |
| |
中央値 |
HR 0.96 (97.5%C.I. 0.80-1.16) |
| CAPOX(初回デザイン) |
7.3ヶ月 |
| FOLFOX4(初回デザイン) |
7.7ヶ月 |
5. サブグループの全生存期間(ITT)
| |
HR |
97.5%信頼区間 |
| CAPOX+BEV vs FOLFOX4+BEV |
0.99 |
0.80-1.23 |
| CAPOX vs FOLFOX4(初回デザイン) |
0.90 |
0.74-1.10 |
6. 治療成功期間(治療中または治療終了後に増悪なく生存)
| |
中央値 |
HR 1.08 (97.5%C.I. 0.97-1.20) |
| CAPOX群 |
5.9ヶ月 |
| FOLFOX4群 |
6.3ヶ月 |
7. 奏効期間(奏効例のうち増悪なく生存)
| |
中央値 |
HR 1.00 (97.5%C.I. 0.85-1.18) |
| CAPOX群 |
7.5ヶ月 |
| FOLFOX4群 |
7.6ヶ月 |
8. 二次治療移行
| |
全割合 |
イリノテカン |
セツキシマブ |
BEV |
| CAPOX群 |
51% |
39% |
7% |
6% |
| FOLFOX4群 |
53% |
41% |
12% |
5% |
9. 有害事象(NCI-CTCAE ver.3)
| |
CAPOX, CAPOX+placebo(n=655) |
FOLFOX4, FOLFOX4+placebo(n=649) |
| Grade |
1 |
2 |
3 |
4 |
1 |
2 |
3 |
4 |
| 悪心 |
224 (34%) |
153 (23%) |
30 (5%) |
0 (0%) |
258 (40%) |
123 (19%) |
33 (5%) |
0 (0%) |
| 下痢 |
171 (26%) |
126 (19%) |
123 (19%) |
9 (1%) |
179 (28%) |
141 (22%) |
70 (11%) |
3 (<1%) |
| 好中球減少 |
16 (2%) |
118 (18%) |
39 (6%) |
6 (<1%) |
18 (3%) |
79 (12%) |
173 (27%) |
106 (16%) |
| 倦怠感 |
108 (16%) |
107 (16%) |
33 (5%) |
1 (<1%) |
131 (20%) |
110 (17%) |
49 (8%) |
2 (<1%) |
| 嘔吐 |
143 (22%) |
103 (16%) |
34 (5%) |
0 (0%) |
141 (22%) |
85 (13%) |
28 (4%) |
0 (0%) |
| 錯覚感 |
137 (21%) |
74 (11%) |
31 (5%) |
0 (0%) |
165 (25%) |
54 (8%) |
25 (4%) |
0 (0%) |
| 胃炎 |
102 (16%) |
30 (5%) |
8 (1%) |
0 (0%) |
162 (25%) |
67 (10%) |
13 (2%) |
0 (0%) |
| 食思不振 |
108 (16%) |
56 (9%) |
16 (2%) |
0 (0%) |
103 (16%) |
59 (9%) |
17 (3%) |
0 (0%) |
| 手足症候群 |
105 (16%) |
53 (8%) |
40 (6%) |
- |
45 (7%) |
13 (2%) |
8 (1%) |
- |
| 便秘 |
97 (15%) |
45 (7%) |
9 (1%) |
0 (0%) |
114 (18%) |
50 (8%) |
15 (2%) |
0 (0%) |
| 発熱 |
82 (13%) |
33 (5%) |
6 (<1%) |
0 (0%) |
119 (18%) |
45 (7%) |
9 (1%) |
0 (0%) |
| 腹痛 |
75 (11%) |
63 (10%) |
36 (5%) |
0 (0%) |
81 (12%) |
66 (10%) |
24 (4%) |
1 (<1%) |
| 血小板減少 |
23 (4%) |
78 (12%) |
39 (6%) |
7 (<1%) |
36 (6%) |
92 (14%) |
20 (3%) |
2 (<1%) |
| 末梢神経障害 |
73 (11%) |
30 (5%) |
24 (4%) |
0 (0%) |
74 (11%) |
33 (5%) |
23 (4%) |
0 (0%) |
| 無力症 |
38 (6%) |
58 (9%) |
26 (4%) |
2 (<1%) |
49 (8%) |
59 (9%) |
22 (3%) |
1 (<1%) |
| |
CAPOX, CAPOX+placebo(n=655) |
FOLFOX4, FOLFOX4+placebo(n=649) |
| Grade 3/4 好中球減少 |
7% |
44% |
| 発熱性好中球減少症 |
0.9% |
4.8% |
| Grade 3/4 静脈血栓症 |
3.8% |
6.3% |
| 下痢 |
19% |
11% |
| Grade 3手足症候群 |
6% |
1% |
| Grade 3/4 末梢神経障害 |
約17% |
約17% |
| Grade 3/4 心血管イベント |
0.9% |
1.4% |
10. サイクル数
| |
中央値 |
範囲 |
| CAPOX, CAPOX+placebo |
7 |
1-16 |
| CAPOX+BEV |
8 |
1-17 |
| FOLFOX4, FOLFOX4+placebo |
10 |
1-24 |
| FOLFOX4+BEV |
12 |
1-25 |
11. 有害事象による治療中止
| |
人数(割合) |
| CAPOX |
170 (26%) |
| CAPOX+BEV |
109 (31%) |
| FOLFOX4 |
161 (25%) |
| FOLFOX4+BEV |
104 (30%) |
10. 治療関連死亡
| |
最終投与〜28日以内 |
最終投与〜60日以内 |
| CAPOX |
14 (2.1%) |
22 (3.4%) |
| CAPOX+BEV |
8 (2.3%) |
9 (2.5%) |
| FOLFOX4 |
11 (1.7%) |
15 (2.3%) |
| FOLFOX4+BEV |
6 (1.8%) |
5 (1.5%) |
切除不能進行再発大腸癌に対する初回治療として、CAPOXはFOLFOX4と比較して無増悪生存期間における非劣性を証明したことから標準治療の1つとなり得る。
執筆:静岡県立静岡がんセンター 消化器内科 レジデント 瀧浪 将貴 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生
