| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 三次治療以降 | 第2相 | 無増悪生存期間 | デンマーク | なし |
試験名 :Danish trail
レジメン:trifluridine/tipiracil (FTD/TPI) + ベバシズマブ
登録期間:2017年8月24日〜2018年10月31日
背景
trifluridine/tipiracil (FTD/TPI)は、後方ラインにおける切除不能大腸癌を対象としたランダム化第3相試験(RECOURSE試験)にて、有意に良好な予後の延長効果を示した薬剤である。しかしながらFTD/TPI単剤療法の予後の改善効果は十分とは言えず、改善の余地がある。そこで、本邦よりFTD/TPI+ベバシズマブ(BEV)併用療法の第1/2相試験(C-TASK FORCE試験)が実施され、良好な結果が報告された。BEVの上乗せ効果を確認すべく、デンマークにおいてFTD/TPI単剤療法とFTD/TPI +BEV併用療法のランダム化第2相医師主導試験を実施するに至った。
シェーマ
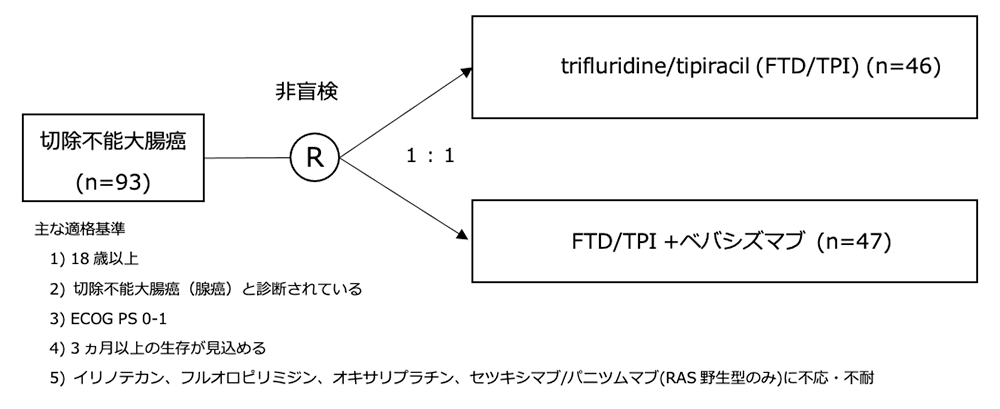
統計学的事項
主要評価項目:治験責任医師の評価に基づく無増悪生存期間
本試験は過去の試験結果よりFTD/TPI単剤療法群の無増悪生存期間中央値を1.8ヶ月、FTD/TPI +BEV併用療法群の無増悪生存期間中央値を3.8ヶ月と推定し、検出力90%、両側 α=0.05として各群の必要症例数は40例と設定された。試験結果:
- 2017年8月24日〜2018年10月31日までの期間に128例がスクリーニングされ、93例がランダム化された(FTD/TPI単独群:46例、FTD/TPI +BEV療法群:47例)。
- 安全性と有効性のデータカットオフは2019年2月15日、追跡期間の中央値は10ヶ月 (IQR 6.8-14.0)、その時点で93例中37例 (40%) が生存していた。
- 患者背景は両群間でバランスがとれていた。
- 治療サイクル数の中央値は、FTD/TPI単独群で2サイクル(IQR 1-4)、FTD/TPI +BEV療法群で4サイクル(IQR 2-6)であった。相対用量強度中央値(範囲)は、FTD/TPI単独群におけるFTD/TPI 0.88 (0.80–0.96) 、FTD/TPI +BEV療法群におけるFTD/TPI 0.80 (0.74–0.90) 、BEV0.86 (0.79–0.92)であった。
- FTD/TPI +BEV療法群では、FTD/TPI単独群と比較して、有意に良好な無増悪生存期間(4.6ヶ月 vs. 2.6ヶ月, p=0.0015)と全生存期間(6.7ヶ月 vs. 9.4ヶ月, p=0.028)の延長効果を認めた。
1. 無増悪生存期間(主要評価項目)
| 中央値 | 95%信頼区間 | HR0.45 (95%CI 0.29-0.72) p=0.0015 |
|
| FTD/TPI 単独群(n=47) | 2.6ヶ月 | 1.6-3.5 | |
| FTD/TPI +BEV療法群 (n=46) | 4.6ヶ月 | 3.5-6.5 |
2. 全生存期間
| 中央値 | 95%信頼区間 | HR0.55 (95%CI 0.32-0.94) p=0.028 |
|
| FTD/TPI 単独群(n=47) | 6.7ヶ月 | 4.9-7.6 | |
| FTD/TPI +BEV療法群 (n=46) | 9.4ヶ月 | 7.6-10.7 |
- 調整因子(RAS変異、施設)により補正した解析結果でも、HR=0.58 (95% CI 0.34–0.99; p=0.048)とFTD/TPI +BEV療法群で有意に良好な生存期間の延長効果が認められた。
3. 腫瘍制御割合
| 中央値 | 95%信頼区間 | p=0.14 | |
| FTD/TPI 単独群(n=47) | 51% | NE | |
| FTD/TPI +BEV療法群 (n=46) | 67% | NE |
NE, not evaluated
- 腫瘍制御割合は有意ではないがFTD/TPI +BEV療法群で良好な結果であった。
4. 有害事象
| FTD/TPI単独群 (n=47) | FTD/TPI +BEV 療法群(n=46) | |||||
|---|---|---|---|---|---|---|
| Grade 1-2 | Grade 3 | Grade 4 | Grade 1-2 | Grade 3 | Grade 4 | |
| 血液毒性 | ||||||
| 好中球減少 | 13 (28%) | 11 (23%) | 7 (15%) | 8 (17%) | 19 (41%) | 12 (26%) |
| 貧血 | 26 (55%) | 8 (17%) | 0 | 29 (63%) | 2 (4%) | 0 |
| 血小板減少 | 8 (17%) | 0 | 0 | 17 (37%) | 1 (2%) | 0 |
| 非血液毒性 | ||||||
| 嘔気 | 30 (64%) | 3 (6%) | 0 | 26 (57%) | 1 (2%) | 0 |
| 下痢 | 15 (32%) | 0 | 0 | 13 (28%) | 3 (7%) | 1 (2%) |
| 嘔吐 | 12 (26%) | 1 (2%) | 0 | 14 (30%) | 2 (4%) | 0 |
| 倦怠感 | 35 (74%) | 5 (11%) | 0 | 36 (78%) | 3 (7%) | 0 |
| 発熱性好中球減少症 | - | 1 (2%) | 0 | - | 2 (4%) | 1 (2%) |
- 高頻度のGrade 3以上の有害事象は、好中球減少であり、FTD/TPI単独群で18例 (38%)、FTD/TPI +BEV療法群で31例 (67%)とFTD/TPI +BEV療法群で高頻度に認められた。その他の項目については、両群間で大きな差は認められなかった。
- 重篤な有害事象は、FTD/TPI単独群で21例 (45%)、FTD/TPI +BEV療法群で 19例 (41%) に認められた。治療関連の重篤な有害事象は、FTD/TPI単独群で嘔吐 (n=2)、便秘 (n=1)、発熱性好中球減少 (n=1)であり、FTD/TPI +BEV療法群で下痢 (n=1)、発熱性好中球減少 (n=3)であった。
- 治療関連死は認められなかった。
5. サブグループ解析
無増悪生存期間
| 因子 | FTD/TPI単独群 (イベント/人) | FTD/TPI +BEV療法群(イベント/人) | HR | 95%CI |
|---|---|---|---|---|
| 年齢 (歳) 70 > 70 ≤ |
27/28 18/19 |
27/36 8/10 |
0.46 0.61 |
0.22-0.70 0.26-1.44 |
| WHO PS 0 1 |
14/15 31/32 |
14/23 21/23 |
0.56 0.37 |
0.31-1.00 0.17-0.79 |
| 原発部位 右側 左側 |
11/11 34/36 |
8/11 27/35 |
0.37 0.49 |
0.15-0.94 0.29-0.84 |
| 転移臓器個数 1 2 3≤ |
7/9 20/20 18/18 |
9/14 16/20 10/12 |
0.41 0.49 0.59 |
0.14-2.21 0.25-0.97 0.27-1.32 |
| 転移の診断から登録までの期間 (ヶ月) <24 24≤ |
17/17 28/30 |
17/21 18/25 |
0.39 0.48 |
0.19-0.80 0.26-0.90 |
| RAS 遺伝子型 野生型 変異型 |
16/18 29/29 |
13/19 22/27 |
0.51 0.43 |
0.24-1.08 0.24-0.78 |
| BEV投与歴 あり なし |
35/36 10/11 |
31/39 4/7 |
0.50 0.27 |
0.30-0.83 0.08-0.89 |
| 登録直前のBEV投与 あり なし |
20/20 25/27 |
22/27 13/19 |
0.54 0.36 |
0.29-1.03 0.18-0.72 |
全生存期間
| 因子 | FTD/TPI単独群 (イベント/人) | FTD/TPI +BEV療法群(イベント/人) | HR | 95%CI |
|---|---|---|---|---|
| 年齢 (歳) 70 > 70 ≤ |
21/28 12/19 |
19/36 4/10 |
0.56 0.42 |
0.30-1.05 0.13-1.30 |
| WHO PS 0 1 |
11/15 22/32 |
10/23 13/23 |
0.49 0.37 |
0.21-1.15 0.31-1.22 |
| 原発部位 右側 左側 |
6/11 27/36 |
5/11 18/35 |
0.74 0.52 |
0.23-2.45 0.28-0.94 |
| 転移臓器個数 1 2 3≤ |
6/9 11/20 16/18 |
6/14 11/20 6/12 |
0.41 0.49 0.59 |
0.14-2.21 0.25-0.97 0.27-1.32 |
| 転移の診断から登録までの期間 (ヶ月) <24 24≤ |
14/17 19/30 |
12/21 11/25 |
0.56 0.48 |
0.26-1.02 0.23-2.08 |
| RAS 遺伝子型 野生型 変異型 |
11/18 22/29 |
11/19 12/27 |
1.08 0.38 |
0.46-2.54 0.19-0.79 |
| BEV投与歴 あり なし |
26/36 7/11 |
21/39 2/7 |
0.61 0.24 |
0.30-0.83 0.05-1.18 |
| 登録直前のBEV投与 あり なし |
14/20 19/27 |
15/27 8/19 |
0.63 0.46 |
0.30-1.32 0.20-1.06 |
- 本試験後に実施された無増悪生存期間と全生存期間に関する探索的なサブグループ解析結果においても、多くのサブグループにおいてFTD/TPI+BEV療法群において良好な結果であった。
結語
切除不能大腸癌における後方ラインとしてのFTD/TPI +BEV療法は、FTD/TPI単独療法と比較し、優れた治療効果と良好な忍容性を示したことから、本レジメンは、切除不能大腸癌の後方ラインにおいて有望な治療選択肢の一つであることが確認された。本レジメンに関しては、1-2次治療における開発が進行中であり、その結果が期待される。
関連論文
1) Kuboki Y, Nishina T, Shinozaki E, et al. TAS-102 plus bevacizumab for patients with metastatic colorectal cancer refractory to standard therapies (C-TASK FORCE): an investigator-initiated, open-label, single-arm, multicentre, phase 1/2 study. Lancet Oncol. 2017; 18:1172-1181 [Pubmed]
2) Kotani D, Kuboki Y, Horasawa S,et al. Retrospective cohort study of trifluridine/tipiracil (TAS-102) plus bevacizumab versus trifluridine/tipiracil monotherapy for metastatic colorectal cancer.
BMC Cancer. 2019 ;19(1):1253. [Pubmed]
BMC Cancer. 2019 ;19(1):1253. [Pubmed]
執筆:大阪医療センター 消化器内科 医師 長谷川 裕子 先生
監修:愛知県がんセンター病院 薬物療法部 医長 舛石 俊樹 先生
監修:愛知県がんセンター病院 薬物療法部 医長 舛石 俊樹 先生