| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 一次治療 | 第3相 | 無増悪生存期間 | 国際 | なし |
試験名 :BICC-C
レジメン:FOLFIRI±Bev vs mIFL±Bev vs CapeIRI
登録期間:2003年2月〜2004年12月
背景
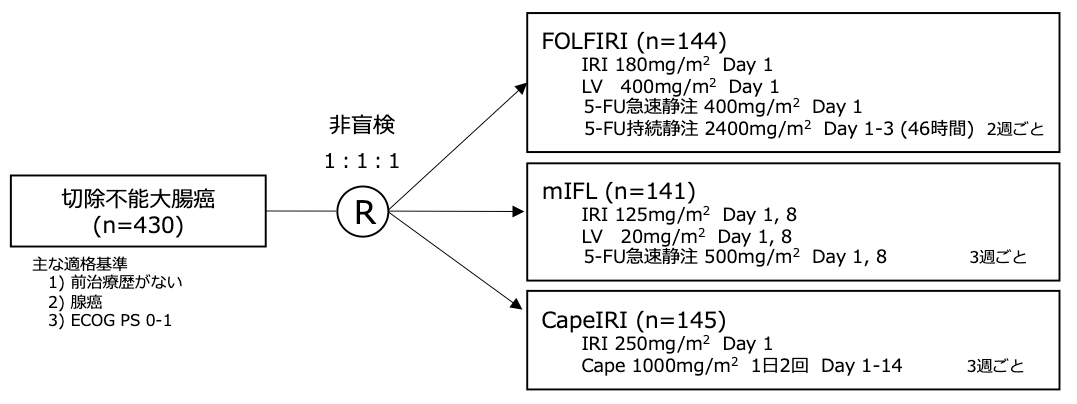
切除不能大腸癌において、5-FU急速静注+ロイコボリン(LV)もしくは5-FU持続静注+LVに対するイリノテカン(IRI)の上乗せ効果が報告されたが、IRIとの併用において最も適切な5-FUの投与方法は明らかとなっていない。またカペシタビン(Cape)+IRIの第2相試験が報告されており奏効割合は5-FU/LV+IRIレジメンの報告と匹敵する結果であったが、直接比較した試験はほとんど行われていなかった。このためIRIと併用する適切なフッ化ピリミジンの投与方法を明らかにするため、5-FU持続静注を用いたFOLFIRI、5-FU急速静注を用いたmIFL、経口フッ化ピリミジンであるCapeを用いたCapeIRIの3群の有効性と安全性を比較検証するランダム化第3相試験(BICC-C試験)が行われた。試験期間中にベバシズマブ(Bev)がFDAにより承認されたため、 2004年4月以降は各レジメンにBevが加えられ、また同時にCapeIRIは毒性の懸念から症例集積が中止された。
シェーマ(Period 1, 2004年3月以前)
シェーマ(Period 2, 2004年4月以降)
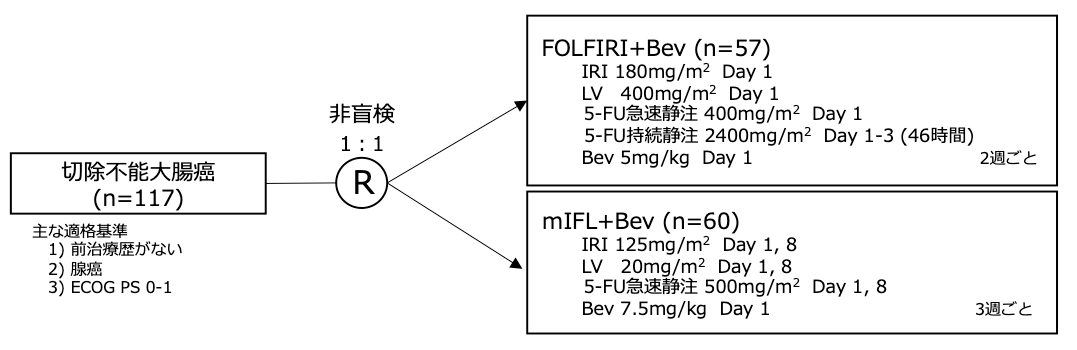
Period 1, 2の期間ともに本試験に登録された患者は1:1でランダムにセレコキシブ400㎎ 1日2回群もしくはプラセボ群に割り付けられた。
統計学的事項
主要評価項目:無増悪生存期間
本試験の主要評価項目は無増悪生存期間(PFS)であり、FOLFIRI群とmIFL群とのPFSの比較を目的とした。副次評価項目でそれぞれの治療群でのPFSが比較された。900例の症例集積を目標として試験が開始されたが、セレコキシブによる心血管イベント増加が報告されて以降、症例集積不良となり547例で試験の集積が打ち切られた。試験結果:
- 2003年2月~2004年12月の間に、4ヵ国 99施設から患者が登録された。
- Period 1(2003年2月〜2004年3月)に430例が登録され、Period 2(2004年4月~2004年12月)に117例が登録され、解析対象となった。
- 17例(3%)が治療を受けなかったため、安全性の解析からは除外された。
- 患者背景には偏りはなかった。
- Period 1のフォローアップ期間中央値は34ヶ月、Period 2は22.6ヶ月であった。
1. 無増悪生存期間:Period 1(主要評価項目)
| 中央値 | HR | 95%信頼区間 | P値 | |
|---|---|---|---|---|
| FOLFIRI(n=144) | 7.6ヶ月 | Reference | ||
| mIFL(n=141) | 5.9ヶ月 | 1.51 | 1.16-1.97 | 0.004 |
| CapeIRI (n=145) | 5.8ヶ月 | 1.36 | 1.04-1.80 | 0.015 |
2. 全生存期間:Period 1
| 中央値 | |
|---|---|
| FOLFIRI(n=144) | 23.1ヶ月 |
| mIFL(n=141) | 17.6ヶ月 |
| CapeIRI (n=145) | 18.9ヶ月 |
OSではそれぞれの群間には有意な差は認められなかった。
3. 奏効割合:Period 1
| 奏効割合 | |
|---|---|
| FOLFIRI(n=144) | 47.2% |
| mIFL(n=141) | 43.3% |
| CapeIRI (n=145) | 38.6% |
4. 無増悪生存期間:Period 2(主要評価項目)
| 中央値 | p=0.28 |
|
| FOLFIRI+Bev(n=57) | 11.2ヶ月 | |
| mIFL+Bev(n=60) | 8.3ヶ月 |
5. 全生存期間:Period 2
| 中央値 | HR 2.34 (95%C.I. 1.34-4.12) p=0.007 |
|
| FOLFIRI+Bev(n=57) | Not reached | |
| mIFL+Bev(n=60) | 19.2ヶ月 |
6. 奏効割合:Period 2
| 奏効割合 | |
|---|---|
| FOLFIRI+Bev(n=57) | 57.9% |
| mIFL+Bev(n=60) | 53.3% |
7. 有害事象:Period 1(NCI-CTC ver.2.0)
| FOLFIRI (n=137) | mFIL (n=137) | CapeIRI (n=141) | ||||
|---|---|---|---|---|---|---|
| Grade 3以上の有害事象 | No. | % | No. | % | No. | % |
| 悪心 | 12 | 8.8 | 10 | 7.3 | 26 | 18.4 |
| 嘔吐 | 12 | 8.8 | 10 | 7.3 | 22 | 15.6 |
| 下痢 | 19 | 13.9 | 26 | 19.0 | 67 | 47.5 |
| 脱水 | 8 | 5.8 | 10 | 7.3 | 27 | 19.1 |
| 好中球数減少 | 59 | 43.1 | 56 | 40.9 | 45 | 31.9 |
| 発熱性好中球減少 | 5 | 3.6 | 17 | 12.4 | 10 | 7.1 |
| 手足症候群 | 0 | 0 | 0 | 0 | 14 | 9.9 |
8. 有害事象:Period 2 (NCI-CTC ver.2.0)
| FOLFIRI+Bev (n=56) | mFIL+Bev (n=59) | |||
|---|---|---|---|---|
| Grade 3以上の有害事象 | No. | % | No. | % |
| 悪心 | 6 | 10.7 | 3 | 5.1 |
| 嘔吐 | 6 | 10.7 | 3 | 5.1 |
| 下痢 | 6 | 10.7 | 7 | 11.9 |
| 脱水 | 3 | 5.4 | 1 | 1.7 |
| 好中球数減少 | 30 | 53.6 | 17 | 28.8 |
| 発熱性好中球減少 | 3 | 5.4 | 1 | 1.7 |
| 高血圧 | 7 | 12.5 | 1 | 1.7 |
結語
切除不能大腸癌に対する一次治療でIRIレジメンを用いる場合、5-FUの持続静注が推奨すべき投与方法と考えられた。
執筆:静岡県立静岡がんセンター 消化器内科 レジデント 古田 光寛 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生