| 対象疾患 | 治療ライン | 研究の相 | 主要評価項目 | 実施地域 | 日本の参加 |
|---|---|---|---|---|---|
| 大腸癌 | 一次治療 | 第3相 | 無増悪生存期間 | 国際 | なし |
試験名 :AVEX
レジメン:Cape+Bev vs Cape
登録期間:2007年7月〜2010年12月
背景
切除不能大腸癌は高齢発症が多く、診断時に年齢が65歳以上であった症例は約61%と報告されている。高齢になるにつれ臓器機能は低下し併存疾患も増えてくるためリスクに応じた治療法を選択すべきであるが、臨床試験では高齢者は除外されていることが多く、高齢者に関するデータは不充分である。
ベバシズマブ(Bev)のランダム化比較試験でのサブグループ解析やpooled analysisによると、高齢者においてもBevは一次治療での併用が予後の延長に寄与することが示唆されており、国際的なガイドラインでは、intensiveな治療に適さない大腸癌患者に対して、5-FUもしくはカペシタビン(Cape)の単独療法、およびこれらとBevとの併用療法が推奨されている。第2相試験ではCape+Bevの高齢者に対する認容性および有望な治療効果が報告されているが、高齢者に限定したBevの有効性を検証した比較試験は行われていない。このため高齢者に限定した切除不能大腸癌一次治療におけるBevの有効性を検証する目的で、第3相優越性試験である本試験が行われた。
ベバシズマブ(Bev)のランダム化比較試験でのサブグループ解析やpooled analysisによると、高齢者においてもBevは一次治療での併用が予後の延長に寄与することが示唆されており、国際的なガイドラインでは、intensiveな治療に適さない大腸癌患者に対して、5-FUもしくはカペシタビン(Cape)の単独療法、およびこれらとBevとの併用療法が推奨されている。第2相試験ではCape+Bevの高齢者に対する認容性および有望な治療効果が報告されているが、高齢者に限定したBevの有効性を検証した比較試験は行われていない。このため高齢者に限定した切除不能大腸癌一次治療におけるBevの有効性を検証する目的で、第3相優越性試験である本試験が行われた。
シェーマ
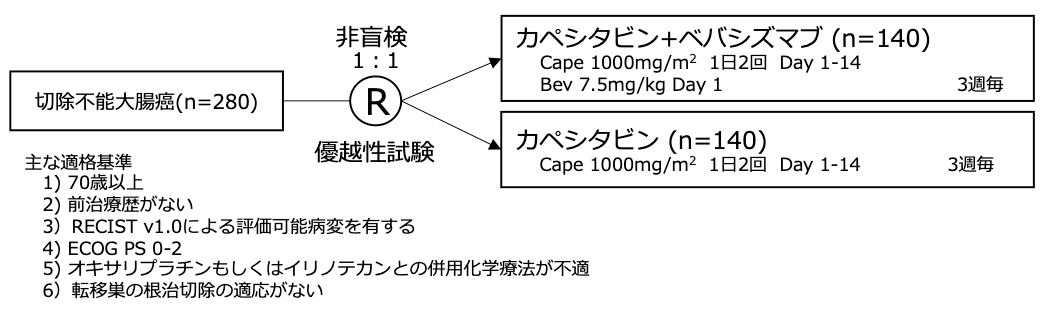
統計学的事項
主要評価項目:無増悪生存期間
本試験の主要評価項目は無増悪生存期間(PFS)とした。Bevの上乗せにより31%の増悪リスクが減少すると見込み(HR=0.69、Capeに対するBevの上乗せによりPFS 4.5ヶ月から6.5ヶ月へ延長)、検出力を80%、両側α=0.05と設定すると、232イベントが必要と見込まれた。36ヶ月の登録期間、12ヶ月のフォローアップ期間から244例が必要と計算され、さらに15%がランダム後に同意撤回すると想定し必要症例登録数は280例とした。試験結果:
- 2007年7月〜2010年12月の期間に40施設より280例が登録され、Cape+Bev群には140例、Cape群には140例が割付られた。
- 有効性解析のデータカットオフは2012年1月19日。フォローアップ期間中央値はCape+Bev群が24.8ヶ月、Cape群が21.6ヶ月であった。
- 最終安全性解析のデータカットオフは2013年3月8日。フォローアップ期間中央値はCape+Bev群が34.4ヶ月、Cape群が29.2ヶ月であった。
- 年齢中央値は両群ともに76歳であった。大部分の患者はECOG PS 0-1であったが、併存疾患に対し投薬治療が行われていた。併存疾患には高血圧や脳梗塞、神経疾患が含まれていた。
Cape+Bev群で原発巣切除歴、術後補助化学療法施行歴のある患者が多く含まれていたが、それ以外では患者背景の偏りは認められなかった。
1. 無増悪生存期間(主要評価項目)
| 中央値 | 95% CI | HR 0.53 (95%C.I. 0.41-0.69) p<0.0001 |
|
| Cape+Bev(n=140) | 9.1ヶ月 | 7.3-11.4 | |
| Cape(n=140) | 5.1ヶ月 | 4.2-6.3 |
2. 奏効割合
| 奏効割合 | p=0.04 | |
| Cape+Bev(n=140) | 19% (CR 3[2%]、PR 24[17%]) |
|
| Cape(n=140) | 10% (CR 2[1%]、PR 12[9%]) |
3. 病勢制御割合
| 病勢制御割合 | p=0.01 | |
| Cape+Bev(n=140) | 74% (CR 3[2%]、PR 24[17%]、SD 77[55%]) |
|
| Cape(n=140) | 58% (CR 2[1%]、PR 12[9%]、SD 67[48%]) |
4. 奏効期間
| 中央値 | 95% CI | |
|---|---|---|
| Cape+Bev(n=140) | 9.0ヶ月 | 8.3-10.0 |
| Cape(n=140) | 9.4ヶ月 | 6.2-12.6 |
5. 全生存期間
| 中央値 | 95% CI | HR 0.79 (95%C.I. 0.57-1.09) p=0.18 |
|
| Cape+Bev(n=140) | 20.7ヶ月 | 17.0-26.0 | |
| Cape(n=140) | 16.8ヶ月 | 12.6-20.1 |
6. 有害事象の要約(NCI-CTCAE ver.3.0)
| Cape+Bev(n=134) | Cape(n=136) | |||
|---|---|---|---|---|
| 因果関係問わず | 治療と関連あり | 因果関係問わず | 治療と関連あり | |
| 全有害事象 | 129 (96%) | 112(84%) | 130 (96%) | 110 (81%) |
| Grade 3以上 | 81 (60%) | 53 (40%) | 60 (44%) | 30 (22%) |
| 重篤な有害事象 | 40 (30%) | 19 (14%) | 42 (31%) | 11 (8%) |
| Grade 5(死亡) | 9 (7%) | 5 (4%) | 14 (10%) | 4 (3%) |
| 治療中断・減量 | 74 (55%) | NA | 59 (43%) | NA |
| 治療中止 | 34 (25%) | NA | 20 (15%) | NA |
7. 有害事象(NCI-CTCAE ver.3.0)
| Cape+Bev(n=134) | Cape(n=136) | |||||||
|---|---|---|---|---|---|---|---|---|
| All grade | Grade 3 | Grade 4 | Grade 5 | All grade | Grade 3 | Grade 4 | Grade 5 | |
| Bev関連 | ||||||||
| 出血 | 34 (25%) | 0 | 0 | 0 | 9 (7%) | 0 | 0 | 1 (1%) |
| 高血圧 | 26 (19%) | 3 (2%) | 0 | 0 | 7 (5%) | 2 (1%) | 0 | 0 |
| 静脈血栓症 | 16 (12%) | 3 (2%) | 7 (5%) | 1 (1%) | 7 (5%) | 4 (3%) | 2 (1%) | 0 |
| 尿蛋白 | 10 (7%) | 2 (1%) | 0 | 0 | 1 (1%) | 0 | 0 | 0 |
| 動脈塞栓症 | 6 (4%) | 2 (1%) | 1 (1%) | 2 (1%) | 3 (2%) | 1 (1%) | 0 | 0 |
| 創傷治癒関連 | 2 (1%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 消化管穿孔 | 1 (1%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Cape関連 | ||||||||
| 手足症候群 | 66 (49%) | 21 (16%) | 0 | 0 | 54 (40%) | 9 (7%) | 0 | 0 |
| 下痢 | 54 (40%) | 8 (6%) | 1 (1%) | 0 | 48 (35%) | 7 (5%) | 2 (1%) | 0 |
| 無力症 | 30 (22%) | 6 (4%) | 1 (1%) | 0 | 22 (16%) | 4 (3%) | 1 (1%) | 0 |
| 疲労 | 32 (24%) | 4 (3%) | 1 (1%) | 0 | 37 (27%) | 1 (1%) | 0 | 0 |
| 悪心 | 32 (24%) | 1 (1%) | 0 | 0 | 37 (27%) | 0 | 0 | 0 |
| 嘔吐 | 28 (21%) | 3 (2%) | 0 | 0 | 16 (12%) | 2 (1%) | 0 | 0 |
| 口内炎 | 20 (15%) | 0 | 0 | 0 | 11 (8%) | 1 (1%) | 0 | 0 |
| 好中球減少症 | 7 (5%) | 0 | 1 (1%) | 0 | 2 (1%) | 1 (1%) | 0 | 0 |
8. サブグループ解析
- 年齢別(70-74歳/75-79歳/80歳以上)でのPFSのサブグループ解析では、すべての年齢でCape群と比較しCape+Bev群が良好な成績であった。
結語
70歳以上のintensiveな化学療法が不適な切除不能大腸癌患者に対する一次治療において、Cape+BevはCapeと比較し無増悪生存期間を延長した。
執筆:静岡県立静岡がんセンター 消化器内科 レジデント 古田 光寛 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生
監修:静岡県立静岡がんセンター 治験管理室 部長、消化器内科 医長 山﨑 健太郎 先生