First-line liposomal irinotecan + 5-fluorouracil/leucovorin + oxaliplatin in patients with pancreatic ductal adenocarcinoma: long-term follow-up results from a phase 1/2 study
First Author : Zev A Wainberg, et al.
膵管癌患者に対する一次治療としてのリポソーム型イリノテカン+フルオロウラシル+ロイコボリン+オキサリプラチン:第1/2相試験の長期フォローアップ結果
背景
転移を有する膵癌に対する一次治療はゲムシタビン+ナブパクリタキセル併用療法、FOLFIRINOX療法(フルオロウラシル+ロイコボリン+非リポソーム型イリノテカン+オキサリプラチン)が確立されている。イリノテカンをリポソーム化する利点は、リポソームの封入による血漿循環時間の延長、腫瘍内での活性代謝物(SN-38)の暴露期間の延長による抗腫瘍活性の増強と考えられており、リポソーム型イリノテカンはゲムシタビン不応転移性膵癌に対する国際共同第3相試験(NAPOLI-1試験)でフルオロウラシル+ロイコボリンへの上乗せ効果を示した。
局所進行または転移を有する膵癌患者に対する一次治療としてのNALIRIFOX(リポソーム型イリノテカン+フルオロウラシル+ロイコボリン+オキサリプラチン)療法の安全性、忍容性、そして有効性を評価するために第1/2相試験が実施され、長期フォローアップの結果が報告された。
対象と方法
主要評価項目はNALIRIFOX療法の安全性と忍容性、用量制限毒性の特徴および推奨用量の決定であり、副次評価項目は抗腫瘍効果だった。また、探索的評価として、腫瘍組織の遺伝子解析によりclassicalとbasal-likeのサブタイプに分類し(Moffitt分類)、無増悪生存期間と腫瘍縮小効果の関連を解析した。
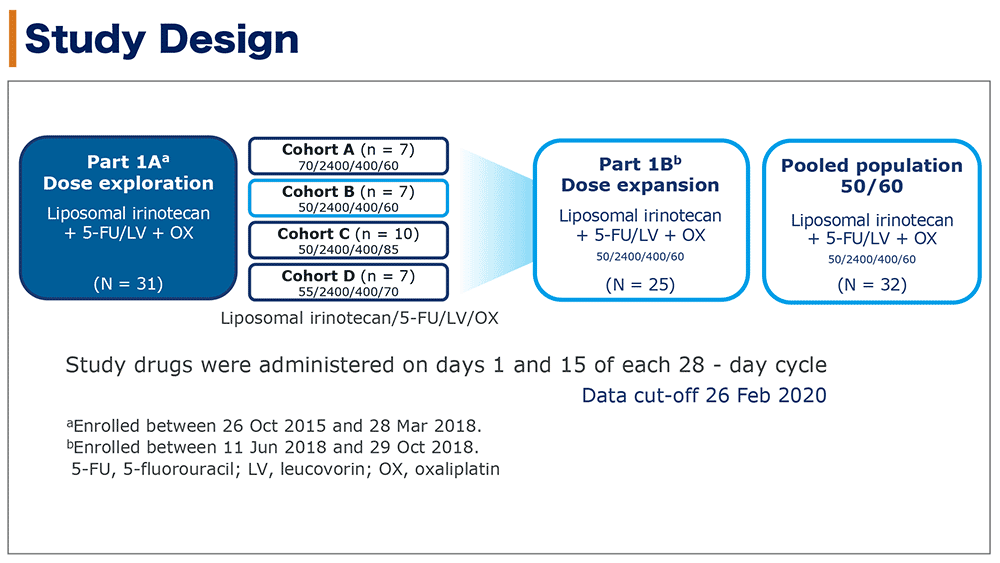
本試験はオープンラベル、2パート(用量探索パート、用量拡大パート)第1/2相試験だった。用量探索パートは3+3デザインで実施した。投与量はフルオロウラシル 2,400mg/m2、ロイコボリン 400 mg/m2を固定し、リポソーム型イリノテカンとオキサリプラチンの投与量を増減する計画とした。推奨用量(リポソーム型イリノテカン 50mg/m2とオキサリプラチン 60mg/m2)となったコホートB 7例と推奨用量を投与した用量拡大パートの25例をあわせた32例をpooled populationとした(図1)。
図1 試験デザイン