TAS-116, an oral HSP90 inhibitor, in combination with nivolumab in patients with colorectal cancer and other solid tumors: an, open-label, dose-finding, and expansion phase Ib trial (EPOC1704)
First Author : Akihito Kawazoe, et al.
切除不能大腸癌とその他の固形腫瘍に対するHSP90阻害薬であるTAS-116とニボルマブ併用療法の非盲検用量探索/拡大第1b相試験(EPOC1704試験)
背景
制御性T細胞(Treg)は抗PD-1/PD-L1抗体薬(A-PD1)の耐性を誘導する可能性が報告されている1)2)。新規のHeat Shock Protein(HSP)90阻害薬であるTAS-116は、in vitroおよびin vivoにおいて、Tregを減少させることにより抗腫瘍免疫を増強した(未発表データ)。このTAS-116とA-PD1の併用療法はin vivoにおいてそれぞれ単独での治療より高い抗腫瘍効果を示した。これらの結果から、本研究では固形腫瘍症例に対してTAS-116+ニボルマブ併用療法の安全性と有効性を検討した。
対象と方法
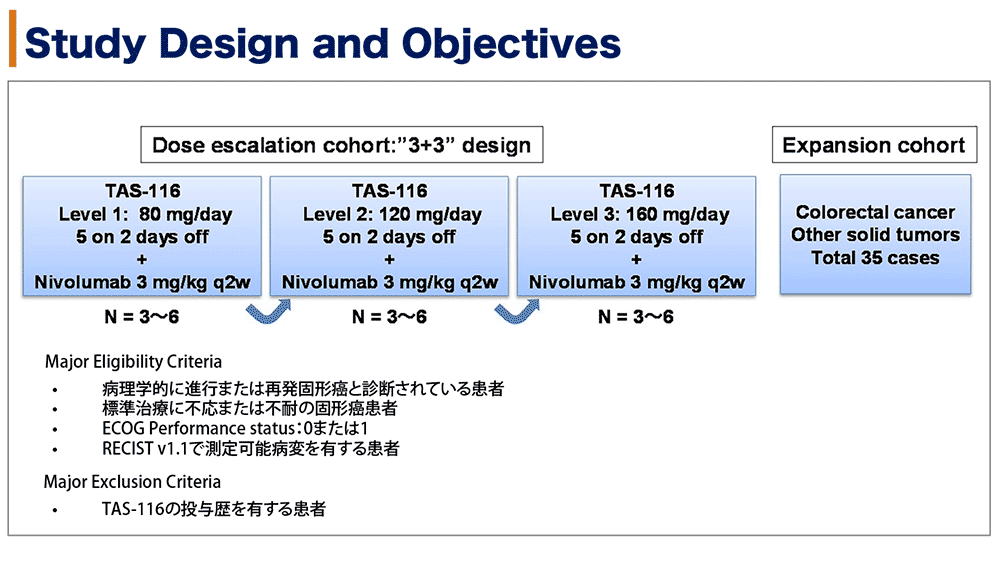
本試験の主な適格基準は、標準治療に不応または不耐となった切除不能固形癌患者で、ECOG PS 0-1、RECIST v1.1による評価可能病変を有する症例であり、TAS-116の投与歴がない症例とされた。
本試験の主要評価項目は最大耐用量と第2相試験における推奨用量を探索するための1サイクル中の用量制限毒性(DLT)であり、副次的評価項目は奏効割合(ORR)、無増悪生存期間(PFS)、全生存期間(OS)、病勢制御割合(DCR)だった。
用量増量コホートでは、ニボルマブ 3mg/kg 2週毎の投与を固定し、TAS-116(5日内服後2日休薬)をLevel 1:80mg/日、Level 2:120mg/日、Level 3:160mg/日と増量する計画とした。Level 1より各Level 3-6例を登録し、DLTの発現が0-1例であれば次のLevelへ移行して最大耐用量/推奨用量を推定する3+3デザインとし、拡大コホートでは決定した推奨用量を切除不能大腸癌とその他の切除不能固形腫瘍、合わせて35例に投与し、安全性と有効性が評価された。
図1 試験デザイン